Фармакологические свойства
Оксиматрин — уникальный тетрациклохинолизидиновый алкалоид. Оксиматрин является активным ингредиентом Софоры лисохвостной, который оказывает противовоспалительное, антибактериальное, противоаллергическое, противоопухолевое, противовирусное (вирус гепатитов В,С), противофиброзное действие, нормализует сердечный ритм, повышает иммунитет и уровень белых кровяных телец, защищает печень, улучшает детумесценцию и диурез, повышает биологическую ответную реакцию.
Оксиматрин ингибирует вирусную репликацию (размножение), уменьшает разрушение клеток печени и защищает от фиброза, а также способствует оттоку желчи.
Оксиматрин регулирует сердечные сокращения, противодействует аритмии, вызванной многими причинами, расширяет коронарные артерии, увеличивает кровоток и улучшает поставку кислорода к сердечным клеткам, противодействует вирусу Коксаки, который вызывает миокардит.
Оксиматрин повышает уровень свободного Ca2+ в цитоплазме, а также сокращает цАМФ (циклический аденозинмонофосфат), таким образом, оксиматрин оказывает действие на иммунную систему путем взаимодействия с клеточной мембраной и изменения уровня Ca2+ и цАМФ.
Оксиматрин непосредственно ингибирует рост опухолевых клеток
Оксиматрин применяется в лечении аллергических заболеваний кожи и инфекций, подавляет клетки кератиноциты, которые воспроизводятся непрерывно, продуцируя характерные чешуйки, уменьшает участки псориаза.
Оксиматрин не оказывает влияние на формироване антитела IgE, но непосредственно действует на клетки селезенки. Ингибирует дегрануляцию тучных клеток, вызванную в значительной степени аллергенами, тем самым останавливая высвобождение гистамина путем снижения текучести тучных клеток.
РАСТВОР ДЛЯ ИНЪЕКЦИЙ 600 мг/2 мл ПРОИЗВОДСТВА “JIANGSU CHIA TAI -TIANQING PHARMACEUTICAL CO.,LTD”, КНР
Отчёт клинического исследования по ограниченной программе
1. ВВЕДЕНИЕ
Торговое название препарата: «Ливерин» - раствор для инъекций
Действующее вещество: оксиматрин
Cостав: каждая ампула раствора содержит:
активное вещество – оксиматрин – 600 мг/2 мл;
Фармакотерапевтическая группа: препараты для лечения заболеваний печени.
Фармакокинетика
После внутривенной инъекции сывороточная концентрация Оксиматрина соответствует двухкамерной фармакокинетической модели. Препарат распределяется главным образом в желчном пузыре, почках, печени и кишечнике, а затем в костном мозге и селезенке, с сохранением препарата в крови в течение длительного времени. Препарат главным образом метаболизируется в печени и почках и выделяется с мочой и калом.
Показания к применению
- хронический вирусный гепатит В и С;
- фиброз и цирроз печени;
- лейкопения, вызванная радиотерапией и химиотерапией;
- обыкновенный псориаз.
Способ применения и дозы
Внутримышечно: по 0,6г (1 ампула), один раз в день.
Внутривенно: 0,6г (1 ампула) развести в 100 – 250 мл 5% раствора глюкозы или 0,9% раствора натрия хлорида. Вводить внутривенно капельно, со скоростью 60 капель в минуту, один раз в день.
Курс лечения хронического вирусных гепатитов В и С составляет 24 недели, фиброза и цирроза печени – 52 недели. В случае невозможности парентерального применению препарата после 8-12-недельного курса продолжить применение препарата в пероральной форме («Ливерин» - капсулы).
После прохождения полного курса лечения необходим осмотр у специалиста, с целью контроля состояния пациента и принятия решения о необходимости продолжения терапии.
Лечение лейкопении, вызванной радиотерапией и химиотерапией: за 3 дня до начала химио- или радиотерапии по 0,6г (1 ампула) внутримышечно или внутривенно капельно - 10 дней. После окончания 10-дневного курса необходим контроль формулы крови и консультация врача для принятия решения о назначении повторного курса лечения.
Курс лечения при обычном псориазе составляет 1 месяц.
Побочные действия
«Ливерин» раствор для инъекций обычно хорошо переносится. Частота возникновения нежелательных реакций низкая. Возможны тошнота, рвота, горечь во рту, диарея, дискомфорт или боль в верхней части живота. Реже возникают кожная сыпь, спертость в груди и жар, которые проходят без дополнительного лечения. Может наблюдаться покраснение или боль на месте введения инъекции. Однако этого можно избежать при глубоком введении.
Противопоказания
«Ливерин» - раствор для инъекций противопоказан пациентам с гиперчувствительностью к оксиматрину и другим компонентам препарата.
Лекарственные взаимодействия
Одновременное применение оксиматрина - раствора для инъекций с циклофосфамидом оказывает синергический лечебный эффект в отношении опухоли Эрлиха и устраняет лейкопению. Совместное применение Ливерина, ИФН альфа-2в и рибавирина взаимно усиливает действие препаратов и снижает частоту проявления побочных эффектов (усиливает противовирусное действие, уменьшает некроз и стимулирует восстановление гепатоцитов, снижает воспаления, регулирует иммунитет).
Особые указания
- Препарат не рекомендуется применять пациентам с острой почечной недостаточностью.
- С осторожностью следует применять «Ливерин»- раствор для инъекций пациентам с печеночной недостаточностью.
Беременность и период лактации
«Ливерин»- раствор для инъекций не рекомендуется применять во время беременности. С осторожностью следует применять «Ливерин»- раствор для инъекций женщинам в период лактации.
Дети
Соответствующих строго контролируемых исследований с детьми не проводилось.
Пожилые пациенты
Необходима соответствующая корректировка дозы.
Особенности влияния лекарственного средства на способность управлять автотранспортом и потенциально опасными механизмами
Не выявлены.
Препарат следует хранить в недоступном для детей месте и не использовать по истечении срока годности.
Передозировка
Особые физические признаки и клинические симптомы при приеме высоких доз «Ливерина»- раствора для инъекций не возникают. Пациенты, получающие лечение высокими дозами «Ливерина»- раствора для инъекций, должны находиться под тщательным наблюдением.
2. ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью исследования являлось изучить гепатопротекторную эффективность и переносимость препарата «Ливерин» - раствор для инъекций 600 мг/2 мл производства “JIANGSU CHIA TAI- TIANQING PHARMACEUTICAL CO.,LTD”, КНР
3. ОСНОВАНИЕ ДЛЯ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ
Решение Президиума Фармакологического комитета (протокол №10 от 04.06.2014г.)
4. ВИД (ДИЗАЙН ИССЛЕДОВАНИЯ)
Ограниченное, открытое, контролируемое с двумя параллельными группами исследование проводилось на базе НИИ эпидемиологии, микробиологии и инфекционных заболеваний МЗ РУз. в отделении гепатологии (заведующий отделением к.м.н. Далимов Т.К.в 2015 году с июня по декабрь месяц. Продолжительность исследования для каждого пациента – 14 дней.
5. ОТБОР БОЛЬНЫХ:
Производился из больных, поступивших на стационарное лечение.
Из них основную группу составили 40 (100%) больных, получающих исследуемый препарат – «Ливерин”- раствор для инъекций 600 мг/2 мл, "Jiangsu Chia Tai- Tianqing Pharmaceutical Co., Ltd"-600 мг/2,0 в/в на 0,9% растворе NaCl один раз в день в течение 14 дней. Контрольную группу составили 30 (100%) больных, получавших гептрал 400 мг внутривенно капельно в течение 14 дней.
5.1. Критерии включения в исследование:
В исследование вошли больные с диагнозом хронический гепатит В и С, находящиеся на стационарном лечении, обоего пола, в возрасте от 18 до 65 лет, давшие письменное информированное согласие на участие в исследовании.
В исследуемых группах исключались другие препараты с аналогичным действием. Были использованы также препараты, необходимые для лечения основного или сопутствующего заболеваний и иные лекарственные средства, совместимые с препаратом, в частности, по показаниям, сердечно-сосудистые, седативные средства, физиотерапевтические процедуры. Доза принимаемых препаратов оставалась неизменной на протяжении всего периода исследования.
5.2. Критериями не включения в исследование были:
- больные, в возрасте до 18 лет;
- беременные;
- женщины в период лактации;
- участие пациента в других клинических исследованиях в течение последних 30 дней;
- отсутствие информированного письменного согласия больного на участие в клиническом исследовании;
- пациенты с наличием повышенной чувствительности к компонентам препарата;
- больные с острой почечной недостаточностью.
Исследование для конкретного больного можно было прекратить в случае возникновения опасных или неприятных для больного побочных реакций, либо при отказе пациента от дальнейшего участия в исследовании.
Так, при приеме препарата Ливерин через 3 дня у 2 (7,5%) больных отмечались головная боль, подташнивание, которые исчезли на 4-6 сутки после уменьшения быстроты вливания данного препарата.
5.3. Рандомизация
Для распределения испытуемых по группам использовался метод простой рандомизации. Исходная таблица распределения пациентов по группам была сформирована на основе случайных чисел, полученных при помощи функции генерации случайных чисел MS Excel, и находился у спонсора.
Само распределение по группам проводилось на основании запечатанных конвертов, предоставляемых спонсором. После включения пациента в исследование и присвоения ему порядкового номера раскрывался соответствующий этому номеру конверт и назначался вложенный в этом конверте препарат.
6. СХЕМА НАЗНАЧЕНИЯ ПРЕПАРАТОВ
Больным основной группы (40 человек) назначался «Ливерин”- раствор для инъекций 600 мг/2 мл по 600 мг/2 мл (1 ампула) в течение 14 дней. Препарат разводился в 200 мл 0,9% изотонического раствора натрия хлорида и вводился внутривенно капельно один раз в день в течение не менее 60 минут.
Больные, которые составили контрольную группу (30 человек), получали «Гептрал» 400 мг внутривенно капельно в течение 14 дней.
Средний возраст больных составил 37,55 лет. Соотношение количества мужчин к женщинам составило 65% / 35%. Следовательно, группы были сопоставимы по полу и возрасту.
19 (47,5%) больным был поставлен диагноз ХВГВ, из них у 9 больных ХВГВ был минимальной степени активности, у 1 больного высокой степени активности, у 9 больных ХВГВ был средней степени активности.
21 (52,5%) больным был поставлен диагноз ХВГС, из них у 6 больных ХВГС был минимальной степени активности, у 15 больных ХВГВ был средней степени активности. Т.е. данные группы были также сопоставимы между собой по диагнозу и этиологии заболевания.
Курс лечения составлял 14 дней.
6.1. Дополнительные виды лечения: в исследовании исключали другие препараты с аналогичным действием. Применяли препараты, необходимые для лечения основного заболевания и иные лекарственные средства, совместимые с препаратом, в частности, по показаниям, сердечно-сосудистые, седативные средства.
Пациенты, участвующие в исследовании, получали препараты, постоянно применяемые для лечения сопутствующих заболеваний. Доза принимаемых препаратов оставалась неизменной на протяжении всего периода исследования.
7. ОБЩИЙ ГРАФИК ИССЛЕДОВАНИЯ
- После исходного обследования пациентам, соответствующим критериям включения для получения у них письменного информированного согласия на участие в исследовании, предоставлялись сведения о действующем веществе и лекарственной форме исследуемого препарата, его дозах, схеме и путях введения, а также периоде лечения.
- При получении от пациента письменного согласия на участие в исследовании ему назначался исследуемый препарат или препарат сравнения.
- Точка отсчета начала участия пациента в исследовании: день первого приема исследуемого препарата или препарата сравнения
- Проводимое лечение подробно описано всем больным, включенным в исследование.
- Любая терапия, связанная с сопутствующими заболеваниями, зарегистрирована в истории болезни и индивидуальной регистрационной форме. Так, у 39 (97,5%) больных отмечался сопутствующий диагноз в виде хронического холецистита, у 1 (2,5%) больной сахарный диабет, у 1 (2,5%) больного хронический гастрит, у 1 (2,5%) больного хронический панкреатит, у 1 (2,5%) больного хронический пиелонефрит, у 1 (2,5%) больного хронический простатит, у 1 (2,5%) больного варикозное расширение вен нижних конечностей, у 1 (2,5%) больного кальцинированная киста печени, у 1(2,5%) больного жировой гепатоз печени.
8. УЧЕТ ПОЛУЧЕНИЯ, РАСХОДА, ХРАНЕНИЯ ИССЛЕДУЕМЫХ ПРЕПАРАТОВ И ПРОЦЕДУРЫ ПРОВЕРКИ СОБЛЮДЕНИЯ ИССЛЕДУЕМЫМИ ПАЦИЕНТАМИ ПРЕДПИСАНИЙ ВРАЧА
Препараты с оформлением акта приема-передачи передавались Заказчиком зав. аптекой с оформлением Акта приёмкипередачи в произвольной форме. Исследуемые препараты хранились отдельно от других назначаемых лекарств.
Было назначено ответственное лицо для выдачи препаратов пациентам. Для учета выдачи больным исследуемого препарата был заведен специальный журнал «Учета выдачи исследуемого препарата и препарата сравнения» с подписями больных, удостоверяющими каждое получение препарата.
В истории болезни, амбулаторной карте зафиксированы начало испытаний (первый прием исследуемых препаратов) и то, что больной добровольно согласился принимать испытуемые препараты.
Процедуры проверки соблюдения больным предписаний врача регламентировались правилами внутреннего распорядка лечебного учреждения, где проводилось исследование.
9. ОБСЛЕДОВАНИЕ
Проводились следующие виды обследования
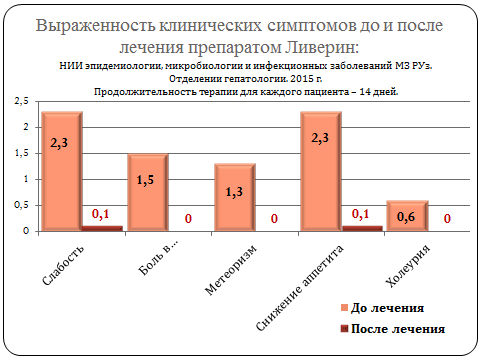
Клиническое обследование: наблюдение за общим состоянием, слабостью, болями в области печени, вздутием живота, аппетитом, изменение цвета мочи.
Клинические анализы: общий анализ крови, общий анализ мочи.
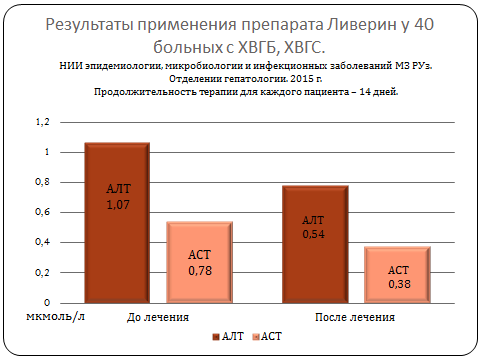
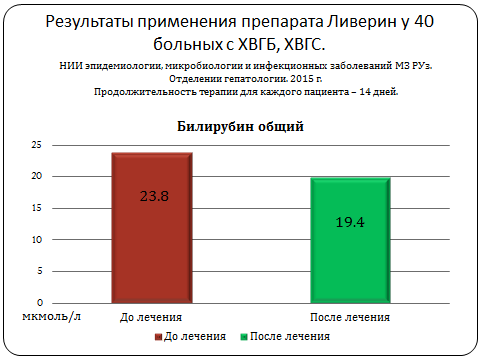
Биохимические анализы: АлТ, АсТ, билирубин, щелочная фосфатаза, тимоловая проба.
Инструментальные исследования: эластометрия печени
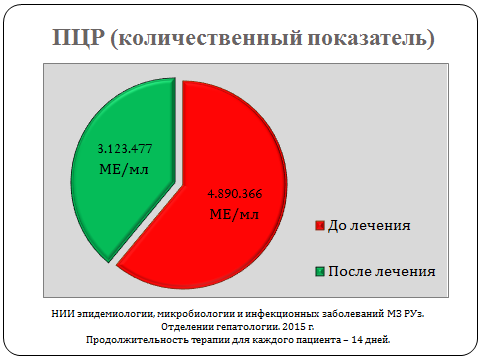
Специальные виды обследования: ПЦР анализ
График проведенния обследования больных:
|
Вид исследования |
Скрининг 0-1 день |
До лечения |
После лечения (14-й день) |
|
Получение письменного информированного согласия |
Х |
|
|
|
Сбор анамнеза и предварительная оценка соответствия пациента критериям включения/не включения |
Х |
|
|
|
Окончательная оценка соответствия пациента критериям включения/не включения |
|
Х |
|
|
Клиническое обследование: |
|
|
|
|
Слабость |
|
Х |
Х |
|
Клинические анализы: |
|
|
|
|
Общий анализ крови |
|
Х |
Х |
|
Общий анализ мочи |
|
Х |
Х |
|
Биохимические анализы: |
|
|
|
|
Биохимический анализ крови: |
|
Х |
Х |
|
Инструментальные исследования |
|
|
|
|
Эластометрия печени с применением аппарата «Фиброскан» |
Х |
|
Х |
|
Специальные виды обследования |
|
|
|
|
ПЦР анализ АСЛ кТА анализ(иммунологический анализ ( печень, мозг) |
Х |
Х |
Х Х |
|
Оценка эффективности (в баллах) |
|
|
Х |
|
Оценка переносимости (в баллах) |
|
|
Х |
10. КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ИЗУЧАЕМОГО ПРЕПАРАТА
10.1 Перечнем показателей эффективности были:
- исчезновение или улучшение клинических симптомов заболевания;
- улучшение показателей биохимических анализов крови;
- оценка результатов эластометрии печени.
Оценка эффективности исследуемого препарата проводилась исследователем на основании вышеперечисленных критериев в баллах по следующей шкале:
|
3 |
Высокая эффективность |
Значительное уменьшение клинических симптомов заболевания к концу курса лечения (сумма баллов 0-5 баллов); значительное улучшение биохимических показателей крови (уменьшение уровня АЛТ на 60-80%) и результатов фибросканирования печени (размер и уплотнение печени, застой в желчных путях, фиброз, стеатоз – значительное улучшение). |
|
2 |
Умеренная эффективность |
Умеренное уменьшение клинических симптомов заболевания к концу курса лечения (сумма баллов 6-10 баллов); незначительное улучшение биохимических показателей крови (уменьшение уровня АЛТ на 40-60%) и результатов фибросканирования печени (размер и уплотнение печени, застой в желчных путях, фиброз, стеатоз – умеренное улучшение). |
|
1 |
Низкая эффективность |
Незначительное уменьшение клинических симптомов заболевания к концу курса лечения (сумма баллов 10-15 баллов); незначительное улучшение биохимических показателей крови (уменьшение уровня АЛТ меньше 40%) и результатов фибросканирования печени (размер и уплотнение печени, застой в желчных путях, фиброз, стеатоз – незначительное улучшение). |
|
0 |
Отсутствие эффективности |
Отсутствие изменений либо ухудшение клинических и лабораторных показателей и результатов фибросканирования печени к концу курса лечения. |
При обследовании больных хроническим вирусным гепатитом В и С после 14 дневного инъекционного приема препарата «Ливерин» пациенты почувствовали достоверное облегчение таких симптомов, как слабость, дискомфорт и боль в области печени, вздутие живота, снижение аппетита.
Установлено статистически достоверное снижение таких лабораторных показателей, как уровень общего билирубина, тимоловой пробы, количественной нагрузки вируса при ПЦР исследовании, что указывало на терапевтическую эффективность данного препарата.
В последние годы для ранней диагностики поражения различных органов и оценки эффективности лечения при инфекционной и неинфекционной патологии применяют метод определения уровня антигенсвязывающих лимфоцитов, специфически сенсибилизированных относительно тканевых антигенов различных органов (Гулямов Н.Г.,2009; Имамова И.А.,2011; Далимов Т.К.,2011). Повышение уровня АСЛ к ТА печени и мозга в динамике указывает на нарастание степени дистрофии в клетках, которая усугубляет нарушения процессов обмена, приводит к потери функциональных возможностей, некрозу клеток и разрушению межклеточных структур. Достоверное снижение данного показателя при инъекционном приеме ливерина указываетна четкое прослеживание эффективности применяемой терапии при хроническом вирусном гепатите В и С
10.2. Методы и сроки оценки, регистрации и статистической обработки показателей эффективности:
Регистрация показателей эффективности проводилась непосредственно после осмотра исследуемого и (или) получения данных лабораторных исследований. Информация, выраженная в виде количественных показателей, подвергалась статистической обработке, в т.ч. и с использованием специальных программных продуктов.
В исследовании применялся метод вариационной статистики с выведением основных параметров по Стьюденту.
10.3 Результаты исследований эффективности
Приведены данные полученных лабораторных исследований, а также других показателей, отражающих эффективность использованного препарата (см. приложение)
Прослеживая динамику изменений клинических и лабораторных показателей, можно отметить положительный эффект лечения исследуемым препаратом.
11. КРИТЕРИИ ОЦЕНКИ ПЕРЕНОСИМОСТИ ИЗУЧАЕМОГО ПРЕПАРАТА
Переносимость исследуемого препарата оценивалось на основании объективных данных, полученных врачом в ходе проведения исследования, и субъективных симптомов, ощущений, о которых больной сообщал самостоятельно. Учитывалась динамика лабораторного обследования, производимого до начала и по завершении курса лечения исследуемыми препаратами. Оценка переносимости исследуемого препарата проводилась на основании вышеперечисленных критериев в баллах от 0 до 4 баллов.
Шкала переносимости исследуемых препаратов:
|
4 балла |
При объективном осмотре и/или лабораторных исследованиях в динамике не выявляются какие-либо патологические изменения или клинически значимые отклонения и/или пациент не отмечает побочных реакций |
|
3 балла |
При объективном осмотре и/или лабораторных исследованиях в динамике выявляются незначительное изменения, которые носят преходящий характер и не требуют изменения схемы лечения исследуемыми препаратами и/или пациент отмечает проявления незначительных побочных реакций, не причиняющие серьезных проблем |
|
2 балла |
При объективном осмотре и/или лабораторных исследованиях в динамике выявляются значимые изменения, не требующие проведения дополнительных мероприятий и/или пациент отмечает проявления побочной реакции, оказывающей отрицательное влияние на его состояние, но не требующее отмены препарата |
|
1 балл |
При объективном осмотре и/или лабораторных исследованиях в динамике выявляются существенные изменения, и/или пациент отмечает проявления побочной реакции, оказывающие отрицательное влияние на его состояние и требующие отмены препарата |
|
0 баллов |
При объективном осмотре и/или лабораторных исследованиях в динамике выявляются значительные изменения, и/или пациент отмечает проявления побочной реакции, требующие отмены препарата и проведения дополнительных медицинских мероприятий |
12. ПОБОЧНЫЕ ЯВЛЕНИЯ
При приеме препарата «Ливерин» через 3 дня у 2 (7,5%) больных отмечались головная боль, подташнивание, которые исчезли на 4-6 сутки после уменьшения быстроты вливания данного препарата.
13. СТАТИСТИКА
Для сравнения результатов, полученных на всей группе пациентов, получавших исследуемый препарат по отношению к исходным показателям и группе сравнения, уровень значимости (р) устанавливался равным 0,05 и 0,01. Значение р=0,01 использовалось в данном случае как дополнительная оценка степени выраженности действия препарата или отличия эффектов препаратов. Наличие достоверных отличий при двух значениях уровня значимости указывало на значительный эффект от применения препарата или на его отличие от препарата сравнения.
14. ПРЕКРАЩЕНИЕ ИССЛЕДОВАНИЯ
При исследовании случаев возникновения у больного побочных реакций, требующих отмены препарата, либо неэффективности, пропуска приёма препарата или отказа пациента от дальнейшего участия в исследовании не отмечалось.
ЗАКЛЮЧЕНИЕ
- Полученные данные позволяют считать, что препарат «Ливерин»- раствор для инъекций 600 мг/2 мл, производства "Jiangsu Chia Тai -Tianqing Pharmaceutical Co., Ltd" является эффективным препаратом для лечения вирусных хронических гепатитов В и С;
- Наш опыт применения препарата «Ливерин»- раствор для инъекций 600 мг/2 мл, производства "Jiangsu ChiaТai- Tianqing Pharmaceutical Co., Ltd" показывает, что препарат обладает хорошим терапевтическим эффектом, достаточной клинической активностью, хорошей переносимостью и может быть рекомендован для медицинского применения и регистрации в Республике Узбекистан в качестве препарата для лечения заболевания печени.
Ответственный исполнитель НИИЭМИЗ МЗ РУз, к.м.н.: Имамова И.А.\